自2019年新《药品管理法》颁发实施以来,我国取消药品GMP认证,监管对象主体以及法律和法规体系也出现重大改变,原有GMP检查制度也不符合现有法律和法规提出的新要求。2024年6月5日,安徽省药监管理局官网发布《关于公开征求安徽省药品生产质量管理规范符合性检查管理办法(征求意见稿)的通知》,会稿截止日期:2024年7月4日。笔者整理了新政

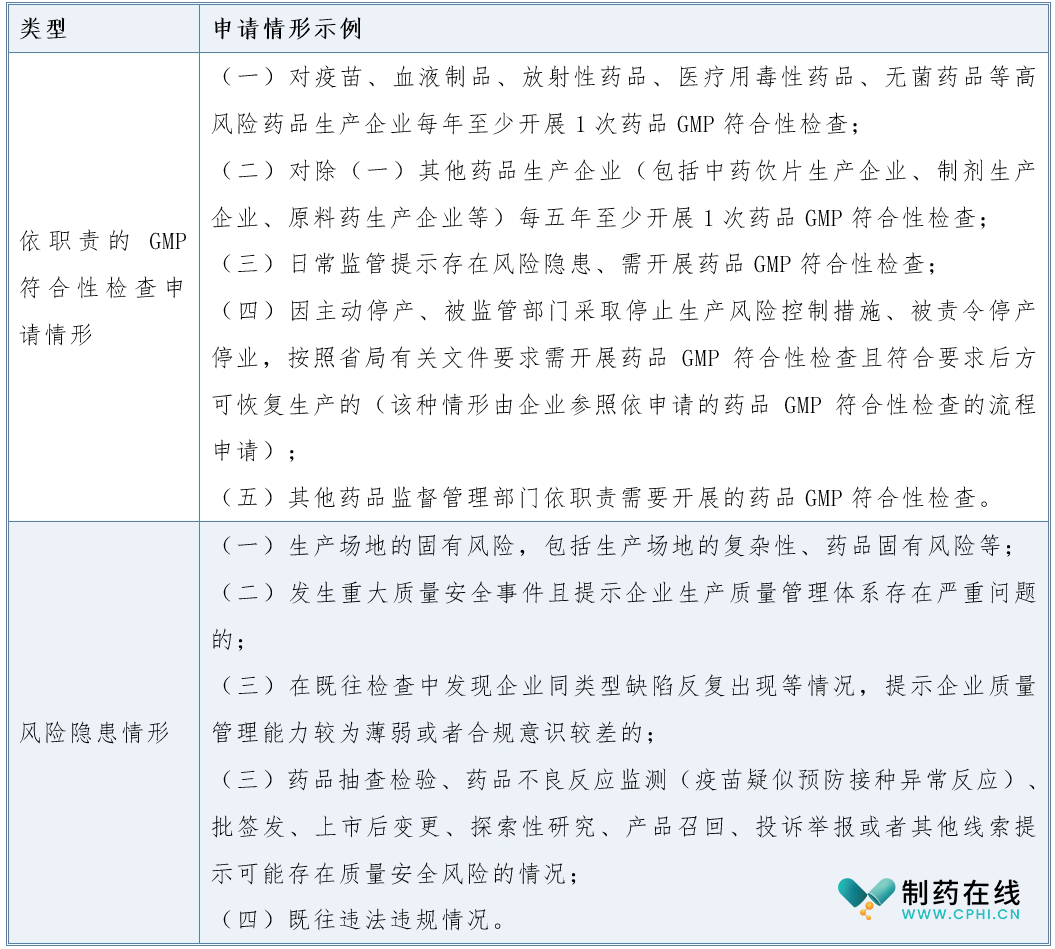
药品GMP符合性检查是药监管理部门依据药品监督管理法律和法规、规章和规范性文件等,对药品上市许可申请人、MAH、药品生产企业(含中药饮片和中药配方颗粒生产企业、制剂生产企业、原料药生产企业等)等实施《药品生产质量管理规范》情况开展的监督检查。药品GMP符合性检查根据任务来源包括依企业申请开展的药品GMP符合性检查(简称:依申请的药品GMP符合性检查)和药监管理部门依职责开展的药品GMP符合性检查(简称:依职责的药品GMP符合性检查)。
是指申请人、持有人、药品生产企业依据药监管理法律和法规、规章和规范性文件等,以及药品批准证明文件明确载明要求,向药监管理部门主动申请的药品GMP符合性检查,分为上市前药品GMP符合性检查、上市后药品GMP符合性检查。

是指药监管理部门依据药监管理法律和法规、规章和规范性文件等,结合监管实际需要,对持有人、药品生产企业实施的上市后药品GMP符合性检查。
在药品生产的严格监管环境中,GMP不仅是行业的标准,更是保障药品质量、安全性和有效性的基石。当某公司作为MAH(药品上市许可持有人)委托B药企生产某品种并成功获得批件后,为确定保证产品顺利上市并符合GMP要求,该公司需要如何申请产品上市前的GMP符合性检查?
让我们来看看自行生产的情形,MAH自己掌握着每一个生产环节。在这种情况下,MAH的责任就显得很重要。他们需要亲自向当地药监部门提交GMP符合性检查申请。
我们来到了药品委托生产的领域。这里的情况更为复杂。(1)当委托生产双方都在一个省/直辖市内时,就如同两个相邻的村庄,互相支持、共同进步。此时,持有人与受托方需要一同提交GMP符合性检查申请。当地药监部门就像是村庄的守护者,会亲临现场,对双方进行细致地检查。这种携手并进的模式,确保了药品生产的每一个环节都符合GMP标准。
(2)当持有人在省/直辖市内、受托方在外省/直辖市时,情况就有些不同了。这如同一个村庄的工匠,将自己的技艺传授给了远方的朋友。此时,持有人要提交检查申请,并附上受托方所在省局出具的证明性材料。这就像是一份信任的背书,证明了受托方同样具备GMP标准的生产能力。当地药监部门会对持有人进行现场检查,并在必要时,对受托方进行延伸现场检查。这种跨省的信任与协作,展现了医药界对于GMP标准的共同追求。
(3)当持有人在外省/直辖市、受托方在省/直辖市内时,情况又发生了转变。这如同远方的工匠,将自己的设计交给了本地的工匠进行制作。此时,受托方要提交GMP符合性检查申请,接受当地药监部门的现场检查。这种情况下,受托方需要承担起更多的责任,确保自己的生产环节符合GMP标准,为远方的持有人提供优质的药品。
中,每一个申请主体都扮演着重要的角色。无论是自行生产还是委托生产,都需要确保药品的质量与安全。而GMP符合性检查,就是GMP符合性检查不可或缺的一环。



