翰宇药业全资子公司翰宇药业(武汉)顺畅完结了为期5天的美国FDA现场核对,FDA依照cGMP规范(现行药品出产质量办理规范)对翰宇药业原料药出产系统、设备设备系统、物料系统、质量操控办理系统、包装贴签系统和质量系统的现场及各类系统文件进行了苛刻、全面、详尽的查验,并于11月29日下午,给予了“零缺点”定论,即未收到任何483表(不契合项)!
此次顺畅经过FDA查看,标志着翰宇药业继2023年龙华总部研制中心“零缺点”经过FDA查看之后,再次获得这一重要效果。这不只再次验证了翰宇药业在质量办理方面的世界*水平,也标志着公司在世界化进程中的脚步愈加稳健,迈向更高的开展方针。
FDA(美国食物药品监督办理局)是由美国联邦政府授权,担任监管食物、药品、化妆品和医疗器械等产品质量与安全的国家机构。经过FDA的查看,意味着产品契合全球高规范,被公认为有用且安全,具有全球商场的认可度。
翰宇药业一直秉持质量至上的开展理念,旗下坪山制剂出产基地、武汉原料药出产基地、龙华总部研制中心等均已经过FDAcGMP规范现场查看,且屡次经过欧盟、韩国、巴西等国家和地区的GMP认证。这为公司利拉鲁肽上市出售以及未来其他产品的世界化奠定了坚实根底。
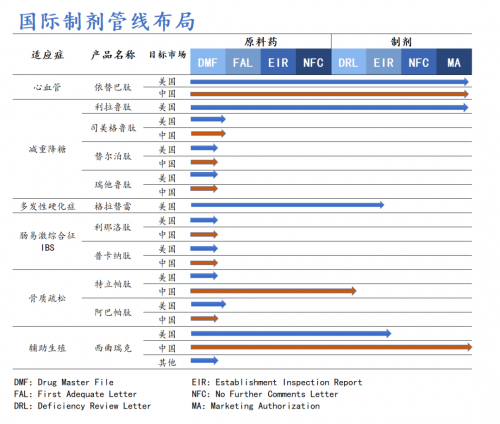
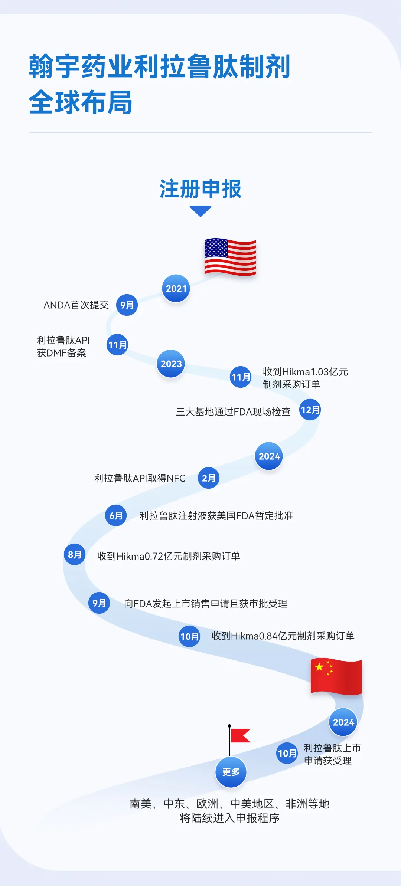
世界制剂管线方面,作为多肽职业的先进企业,翰宇药业坚持技术创新,不断拓宽产品管线布局,活跃寻觅优势互补、资源共享的优质世界合作伙伴,世界管线布局包括利拉鲁肽、司美格鲁肽、替尔泊肽、瑞他鲁肽、格拉替雷等重磅产品。其间利拉鲁肽已于9月23日向FDA建议上市出售请求且获美国FDA受理,方针审评日期为2024年12月23日。
此外,多肽原料药方面,翰宇药业能够在必定程度上完结简直一切已上市多肽药物原料药的开发和出产,并对长链多肽原料药(氨基酸数量在30个以上)的开发具有独特的技术优势。现在,公司已有30多个多肽原料药获得《药品出产许可证》,为满意海外商场增量需求,翰宇药业武汉原料药出产基地产能可达吨级。
未来,翰宇药业将持续发挥FDA认证带来的质量优势,慢慢地加强归纳竞争力,为公司的高水平质量的开展和提高世界商场品牌影响力打下愈加坚实的根底!



